Žák/yně
Ovládání nástroje on-line kalkulačky Laboratorního průvodce a jeho praktické využití při řešení reálných úloh na hmotnostní zlomek.
Nahrazení rutinní činnosti výpočtů koncentrací připravovaných roztoků v chemické laboratoři efektivním využitím jednoho z nástrojů Laboratorního průvodce (informačního portálu pro oblast laboratorní praxe) bez nutnosti vyhledávání hodnot hustot roztoků.
Úlohu 1 řešíme se žáky společně. Nejdříve necháme žáky vypočítat potřebné údaje klasicky. Hodnotu hustoty, potřebnou k ručnímu výpočtu, je vhodné žákům sdělit. Následuje užití nástroje Laboratorní průvodce a porovnání výsledků. Nyní máme příležitost se žáky diskutovat o (pro naši potřebu zatím nijak významném) rozdílu v hodnotách zjištěných objemů, které při výpočtu ovlivňuje hustota (závisející na teplotě). Při ručním výpočtu si její hodnotu musíme v nějakém zdroji informací najít, při on-line výpočtu tato povinnost odpadá. Nástroj obsahuje skrytou databázi hodnot molární hmotnosti a hustoty látky (roztoku).
Pro zápis desetinného čísla do systému používáme místo čárky tečku.
Také druhou úlohu je vhodné nechat děti spočítat předem, např. jako domácí úkol, aby měly další srovnání s on-line výpočtem.
Volba metody řešení poslední úlohy je na učiteli. Úlohu 3 již ručně nepočítáme. Žáci mohou pracovat nejdříve samostatně a pak společně interpretovat postup a výsledky, nebo od začátku frontálně.
Kolik a) gramů, b) cm3 15% roztoku připravíme z 2 g KOH? Kolik ml vody budeme k přípravě potřebovat?

V dolní polovině stránky se zobrazí nabídka on-line nástrojů (např. Konvertor jednotek, Stopky a budík, Fyzikální a chemické tabulky apod.), obr. 2. Jako poslední je uveden On-line výpočet koncentrací, který dále budeme využívat.
Nástroj on-line výpočtu koncentrací obsahuje dvě základní tabulky. První je určena pro řešení zadání zaměřených na roztok jedné látky v kapalině, užitím druhé počítáme úlohy o směšování dvou roztoků. Pod každou z tabulek je uveden stručný návod použití nástroje a ukázkové příklady, obr. 3.
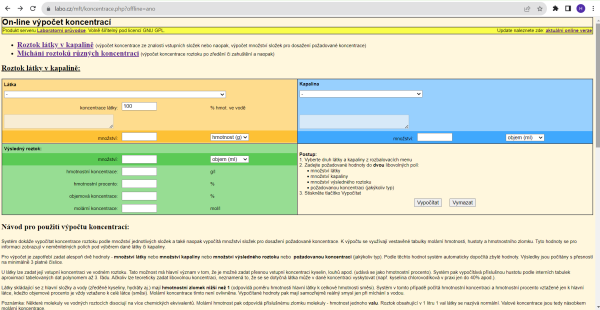
Ovládání nástroje je velmi jednoduché, intuitivní. Známé údaje zapisujeme do bílých polí, v případě výběru látky či kapaliny využíváme nabídku z abecedního seznamu. V poli označeném „množství“ vybíráme ze dvou veličin: hmotnost (v gramech) nebo objem (v mililitrech).
Pro řešení naší úlohy vyplníme v horní části tabulky druh rozpouštěné látky a její množství v gramech, v části Výsledný roztok zadáme hodnotu hmotnostního zlomku v procentech, v pravém sloupci vybereme z nabídky kapalin vodu (obr. 4).
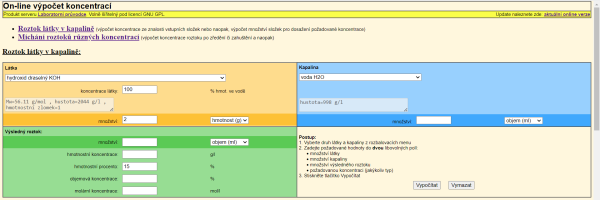
Protože se jedná o rozpouštění pevné (chemicky čisté) výchozí látky, ponecháme automaticky nabízenou hodnotu 100 hmotnostního procenta, kterou lze podle potřeby také měnit. Kliknutím na tlačítko Vypočítat on-line kalkulátor provede výpočty a zobrazí tyto výsledky, obr. 5.
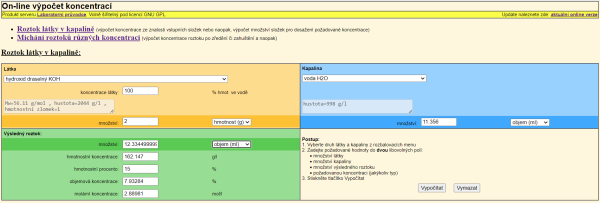
Nyní se vrátíme k otázkám ze zadání příkladu. Z tabulky vidíme, že ze dvou gramů KOH připravíme asi 12,3 ml (cm3) 15% roztoku a budeme k tomu potřebovat přibližně 11,36 ml vody. Pro zjištění údaje o hmotnosti připravovaného roztoku stačí v části Výsledný roztok vybrat místo veličiny objem (v ml) veličinu hmotnost (v g). Automaticky se číselná hodnota přepočítá. Hmotnost připravovaného roztoku tak bude asi 13,3 g.
2. Výpočtem
Zjistěte potřebné hodnoty pro přípravu 0,5 litru 10% vodného roztoku Na2CO3 z bezvodého uhličitanu sodného.
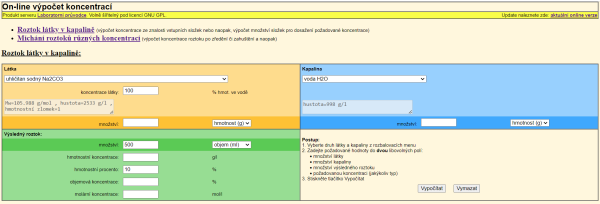
Potvrzením Vypočítat získáme zbývající číselné údaje, obr. 7.
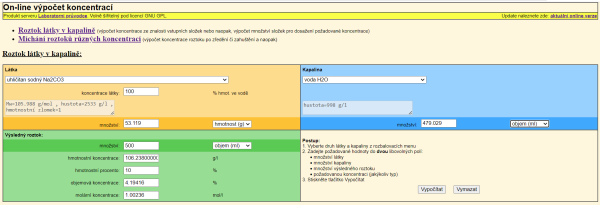
K přípravě 0,5 litru 10% roztoku uhličitanu sodného budeme potřebovat navážit přibližně 53 g bezvodé látky a odměřit 480 ml vody.
Porovnáme-li hodnoty hmotnosti látky získané z on-line nástroje a tradičně spočítané, opět vidíme určitý rozdíl, jehož jednou z příčin je zřejmě odlišná hodnota hustoty látky. Někteří žáci mohou najít způsob jak zjistit, s jakou hustotou 10% roztoku uhličitanu sodného on-line nástroj počítá. Sečtou množství vody v gramech s hmotností látky a součet vydělí objemem výsledného roztoku. Vychází \[ \small\varrho~\doteq1{,}06236~\mathrm{g/cm^3} \].
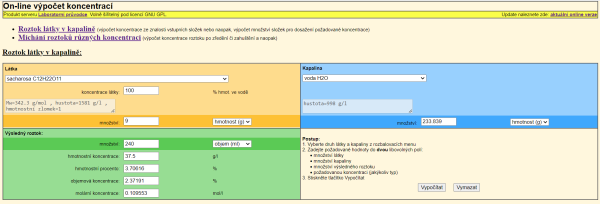
Pro prvního pacienta bylo připraveno 240 ml sladkého roztoku rozpuštěním 9 g sacharózy. Při přípravě stejného objemu sladkého roztoku pro druhého pacienta s cukrovkou byly použity místo sacharózy dvě tabletky sacharinu (umělé sladidlo). Při výpočtech uvažujte, že tabletka sacharinu je chemicky čistá látka.
a. Zřejmě diabetik, protože přestože dostal jen dvě tabletky sladidla do stejného objemu roztoku, odpovídají většímu množství cukru než je 9 gramů.
b. Pouze ve specializovaných chemických tabulkách se podaří najít hustoty vodných roztoků sacharózy. Vyhledat hustoty vodných roztoků sacharinu už není příliš snadné. Ale víme, že se v on-line výpočtu bez nich obejdeme. Naopak, v úloze cílíme i na stanovení hustoty, se kterou digitální nástroj počítá.
Dvě tablety sacharinu odpovídají 12,5 gramům sacharózy. Obrázky 8 a 9 prezentují řešení výpočtu hmotnostního zlomku. Hmotnostní zlomek (v %) roztoku cukru je přibližně 3,7 %, pro roztok sacharinu má hodnotu asi 5,3 %. Také tento výpočet potvrzuje hypotézu v a).
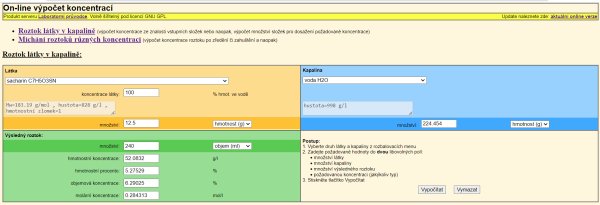
c. Z tabulky vyčteme hmotnost vody, k níž připočteme hmotnost pevné látky a získáme tak hmotnost roztoku. Hustotu roztoku vypočítáme užitím známého vzorce \[ \small \varrho=\frac{m}{V} \].
U sacharózy byla v on-line výpočtu použita hustota \[ \small \varrho=1{,}101\,2\,\mathrm{g/cm^3} \], u sacharinu \[ \small \varrho = 0{,}987\,4\,\mathrm{g/cm^3} \].
Pro využití materiálu ve třídě, kde se chemie učí teprve prvním rokem, je vhodné řešit pouze jednoduché příklady, jako je v úloze 1 varianta a). Jinak zpravidla narazíme na potíže s matematickým aparátem žáků. Žáci posledního ročníku ZŠ a odpovídajících tříd víceletých gymnázií si s úlohami poradí lépe.
Článek je publikován pod licencí Creative Commons - Uveďte původ-Neužívejte komerčně-Nezpracovávejte 3.0 ČR .
Článek nebyl prozatím komentován.
Pro vložení komentáře je nutné se nejprve přihlásit.
Článek není zařazen do žádného seriálu.
Materiály s klíčovým slovem NPO 3.1 DIGI vytvořil tým metodiků v projektu Podpora škol v kontextu digitalizace (Národní plán obnovy 3.1 DIGI) pro podporu pedagogů při ICT revizích.
Další informace, metodické materiály i inspiraci do výuky jednotlivých předmětů i napříč předměty najdete na webu https://digitalizace.rvp.cz/

Národní pedagogický institut České republiky © 2025