V reálném životě se velmi často setkáváme s vyjádřením složení roztoků, které obsahují rozpuštěnou (nejčastěji pevnou) látku, pomocí hmotnostní koncentrace; to znamená množství látky v gramech rozpuštěné v jednom litru roztoku (jednotky g/l resp. g/dm3), mnohdy udávané i v %. Jako příklad uveďme složení infuzních roztoků ve zdravotnictví, informace o limitní hodnotě přítomných dusičnanů (či jiných škodlivých látek) v pitné vodě, vyjádření cukernatosti v nápojích, obsah účinné látky v čisticích a dezinfekčních prostředcích, ale i doporučená koncentrace chloru ve veřejných plaveckých bazénech.
Jestliže roztok obsahuje rozpuštěnou kapalinu nebo plynnou látku, pak ukazatelem složení této směsi může být objemová koncentrace, vyjadřující podíl objemu složky k objemu celého roztoku. Jedná se o bezrozměrnou veličinu o teoretické maximální hodnotě 1, proto se častěji uvádí její stonásobek – vyjádření v procentech (značíme % obj.). Z praxe jistě známe údaje z etiket alkoholických nápojů, parfémů nebo dezinfekčních prostředků, které nás informují o obsahu objemových procent alkoholu. Setkáváme se také například se sdělením při označení paliva obsahujícího objemová procenta bioethanolu. Z vinět sycených nápojů se dozvíme, kolik objemových procent rozpuštěného \[ \mathrm{CO_{2}} \] obsahují, a stejně tak dýchací směsi používané hlavně ve zdravotnictví musí obsahovat informaci o aktuálním množství kyslíku ve směsi.
Třetím způsobem vyjádření složení roztoku, který zde zmíníme, je molární koncentrace. Vyjadřuje počet molů určité látky rozpuštěné v jednom litru roztoku s nejčastěji užívanými jednotkami mol/l, resp. mol/dm³. Se složením roztoků vyjádřeným pomocí molární koncentrace se často setkáváme především v chemických, farmaceutických i medicinských laboratořích. Tímto způsobem mohou být vyjádřena složení elektrolytů při povrchových úpravách a zpracování kovů, například galvanickém pokovování, v zemědělství se zase takto uvádí složení dusíkatého hnojiva.
V článku se zaměříme na tři uvedené způsoby vyjadřování složení směsí a ukážeme si několik příkladů vycházejících z praxe, při jejichž řešení efektivně využijeme online nástroj výpočtu koncentrací https://labo.cz/mft/koncentrace.php?offline=ano.
Kalkulátor je jedním z volně šiřitelných produktů serveru Laboratorní průvodce (informační portál pro oblast laboratorní praxe): https://www.labo.cz/. Ten obsahuje řadu užitečných nástrojů pro chemii, fyziku, informatiku a matematiku. Součástí nástroje pro výpočet koncentrací jsou dvě výpočtové tabulky. První, nazvaná Roztok látky v kapalině, řeší úlohy jedné látky rozpuštěné v kapalině. Můžeme zde trénovat výpočty na hmotnostní koncentraci, hmotnostní procento, objemovou koncentraci a molární koncentraci konkrétní látky, kterou vybíráme z nabízeného seznamu, stejně tak rozpouštědlo. Systém má zabudovanou vlastní databázi hustot látek. Více informací a ukázku příkladů využití této výpočtové tabulky najde čtenář v článku Výpočty na hmotnostní zlomek s využitím on-line nástroje Laboratorní průvodce.
Druhá výpočtová tabulka Míchání roztoků různých koncentrací (obrázek 1, pro jeho zvětšení na obrázek klikneme) řeší – jak je na webových stránkách uvedeno – pouze úlohy zaměřené na dva roztoky a veličiny vztažené k objemu (v závorce uvedeny použité jednotky): hmotnostní koncentrace (g/l), objemové procento (%) nebo molární koncentrace látky (mol/l). Množství látek zadáváme pomocí objemu v mililitrech nebo v litrech.
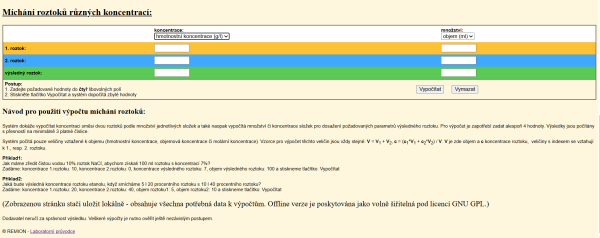
Algoritmus, který kalkulátor využívá, vychází z předpokladu, že nedochází k objemové kontrakci (což je možné při mísení plynů a u velmi zředěných roztoků srovnatelných hustot), proto lze objemy sčítat. Směšovací rovnice má tak tvar \[ c_1V_1+c_2V_2=(V_1+V_2)c \], kde c je koncentrace (hmotnostní, objemová nebo molární) roztoku (prvního, druhého, nebo výsledného); V je objem (prvního nebo druhého) roztoku.
Tabulka obsahuje šest bílých polí pro číselné údaje, desetinná čísla zapisujeme s desetinnou tečkou. Nad první trojicí těchto polí vidíme nabídku pro volbu typu koncentrace, vpravo pak můžeme vybrat z nabízených dvou jednotek objemu (ml a l). Pro vyřešení úlohy musíme vyplnit vždy číselné hodnoty ve čtyřech z uvedených šesti polí. Zbytek dopočítá kalkulátor. Pod zobrazenou tabulkou je stručný návod k použití a dva jednoduché ukázkové příklady, avšak bez výsledků.
Umožníme-li žákům (spíše na střední než základní škole) využívat tuto na ovládání jednoduchou a intuitivní výpočtovou tabulku, podpoříme rozvoj jejich digitálních kompetencí. Slabším žákům tímto způsobem můžeme usnadnit práci s ručními výpočty. Více se pak můžeme věnovat například odhadům výsledků, analýze a pochopení souvislostí zobrazených údajů. Vznikne větší prostor například pro interpretaci zjištěných údajů a případnou diskusi s možností formulace dalších otázek, k jejichž zodpovězení využijeme informace v tabulce. Lze zadávat i různé varianty problémových úloh, při jejichž řešení žáci posílí rozvoj svého logického myšlení a porozumění praktickým důvodům různého způsobu zadání koncentrací látek. Upevní si také znalosti z oblasti aplikované chemie. Pro inspiraci uvádíme několik ukázkových příkladů z reálného života, včetně řešení, které využívá zvolený nástroj online výpočtu koncentrací. (V popisu řešení používáme jednotky definované v online kalkulátoru.) Můžeme samozřejmě také nechat žáky ověřit správnost získaných výsledků ručním výpočtem.
Jako fyziologický roztok označujeme roztok NaCl o hmotnostní koncentraci 0,9 % ve vodě. To znamená 9 g soli rozpuštěné v jednom litru vody. V laboratoři je k dispozici roztok o hmotnostní koncentraci 9 %. Laborantka má za úkol připravit dva litry fyziologického roztoku. Jaký objem vody a jaký objem 9% roztoku použije?
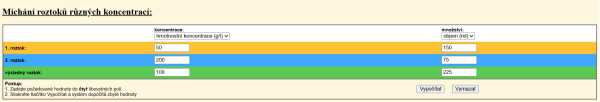
Hmotnostní koncentrace dispozičního roztoku NaCl je 9 g/l . Budeme roztok ředit vodou, proto si musíme uvědomit, že teoreticky vodu chápeme jako roztok NaCl o hmotnostní koncentraci 0 g/l. Doplníme známé údaje správně do tabulky (obr. 2) včetně volby veličiny a jednotky.

Po kliknutí na tlačítko Vypočítat se zobrazí dopočítané hodnoty, obr. 3.

Z výsledku vyplývá, že laborantka musí použít pro správné ředění 0,2 litru 9% roztoku a 1,8 litru vody.
Ve zdravotnictví se používají léčivé přípravky obsahující glukózu o těchto hmotnostních koncentracích: 5 %, 10 %, 20 % a 40 %. Dva laboranti mají za úkol připravit 750 ml glukózového roztoku o hmotnostní koncentraci 15 %. První k přípravě použije 10% a 40% roztoky, druhý roztoky o koncentracích 5 % a 20 %. Jak připraví výsledný roztok?
Je-li hmotnostní koncentrace glukózy 5 %, znamená to, že v tomto roztoku je rozpuštěno 50 g glukózy v jednom litru vody. Analogicky lze odvodit hodnoty obsažené glukózy u zbývajících roztoků a doplnit tabulku pro každého z laborantů.
První laborant použije 625 ml 10% roztoku a 125 ml 40% roztoku glukózy (obr. 4).

Druhý laborant použije 250 ml 5% roztoku a 500 ml 20% roztoku glukózy (obr. 5).

Laborantka má 150 ml 5% roztoku glukózy, ke kterému musí přidat 20% roztok glukózy, aby připravila infuzní glukózový roztok o koncentraci 10 % pro diabetického pacienta. Jaký objem 20% roztoku použije?
K přípravě infuzního roztoku laborantka použije 75 ml 20% roztoku glukózy (obr. 6).
Pro přípravu salátové zálivky kuchař smíchal 20 ml 8% octa a 480 ml vody. Jaký objem a kolikaprocentní roztok octa připravil?
Podle vyhlášky o požadavcích na nápoje, kvasný ocet a droždí musí být uvedena kyselost octa v procentech (m/V), to znamená, že údaj značí hmotnostní koncentraci a jeden litr octa obsahuje 80 gramů kyseliny octové.
Kuchař připravil 500 ml octového roztoku s obsahem 3,2 g kyseliny octové v jednom litru (obr. 7), to znamená 0,32% roztok.

Automechanik má jeden litr 100% obj. etylenglykolu a 10 litrů komerční ředěné směsi obsahující 25 % obj. stejné látky. Potřebuje připravit nemrznoucí směs s obsahem etylenglykolu o koncentraci 40 % obj. Jaký objem 40% obj. roztoku chladicí nemrznoucí kapaliny připraví smícháním jednoho litru koncentrovaného etylenglykolu s komerčně ředěnou směsí? Jaký objem této směsi k tomu bude potřebovat?
Tento příklad obsahuje poměrně dost číselných informací, je nezbytné správně pochopit zadání. Pro korektní výpočet vyplníme všechny údaje v prvním sloupci tabulky a pouze v prvním řádku druhého sloupce. Po výpočtu a řádné interpretaci údajů v tabulce zformulujeme odpověď: Automechanik připraví 5 litrů 40% roztoku chladicí kapaliny a použije k tomu 4 litry směsi, viz obrázek 8.

Zemědělec má plný 25litrový kanystr paliva E85. Toto palivo obsahuje 85 % obj. ethanolu a 15 % obj. benzinu. Pro přípravu 10 litrů paliva do motorových nástrojů (sekačky, pily, křovinořezy) s obsahem 5 % obj. ethanolu bude potřeba přidat benzin. Určete, kolik litrů paliva E85 a kolik litrů benzinu musí zemědělec smíchat.
Úlohu lze řešit dvěma způsoby. Můžeme nejdříve vypočítat objem spotřeby paliva E85 pro přípravu 10 litrů paliva s obsahem 5 % ethanolu a následně toto číslo odečíst od 10 litrů. Při řešení druhým způsobem budeme počítat přímo objem potřebného benzinu, který uvažujeme jako 0% ethanol. Uvádíme řešení druhým způsobem, viz obrázek 9. Zemědělec smíchá asi 0,6 litru paliva E85 a 9,4 litru benzinu.

Pro účely experimentálního modelu galvanického článku je třeba připravit z jednoho litru dvoumolárního roztoku síranu měďnatého elektrolyt - roztok o nové koncentraci 0,5 mol/dm³ . Jakým způsobem jej připravíme?
Abychom připravili roztok s nižší molární koncentrací, než má zásobní roztok, budeme jej ředit vodou. Při výpočtu ji uvažujeme jako roztok síranu měďnatého o koncentraci 0 mol/l . Výpočet je poměrně jednoduchý, k jednomu litru dvoumolárního roztoku síranu měďnatého přidáme tři litry vody, připravíme tak 4 litry roztoku elektrolytu, viz obrázek 10.

Automechanik kontroluje starší olověný akumulátor, ve kterém část elektrolytu unikla. Zjistil, že je v baterii pouze 0,6 litru kyseliny sírové o koncentraci 3,7 mol/l, což znamená, že má akumulátor nízkou kapacitu. Aby došlo k jejímu navýšení, je třeba doplnit elektrolyt zásobním roztokem kyseliny sírové na celkový objem 1,5 litru a dosáhnout hodnoty molární koncentrace kyseliny sírové 4,5 mol/l. Určete molární koncentraci přidané kyseliny sírové.
Hodnotu molární koncentrace přidané kyseliny sírové vyčteme z druhého řádku prvního sloupce tabulky (obrázek 11). Přidaná kyselina je přibližně pětimolární.

Farmář využívá jako listovou výživu pro obilí roztok dusičnanu amonného o koncentraci 1,8 mol/l. K dispozici má zásobní roztoky o koncentracích 2,5 mol/l a 1,0 mol/l. Jaké má možnosti k přípravě 100 litrů postřikového roztoku? Bude mu stačit 50 litrů roztoku o koncentraci 2,5 mol/l?
Roztok o koncentraci 1,8 mol/l může farmář připravit dvěma způsoby. Prvním způsobem je naředění roztoku o koncentraci 2,5 mol/l vodou. Musel by smíchat 72 litrů roztoku s 28 litry vody, jak ukazuje tabulka na obrázku 12.

Při přípravě směsi druhým způsobem použije farmář oba dispoziční roztoky dusičnanu amonného. Z obrázku 13 je patrné, že musí smíchat asi 53,3 l roztoku o vyšší koncentraci a 46,7 l jednomolárního roztoku.

Odpověď na poslední zadanou otázku (Bude farmáři stačit 50 litrů roztoku o koncentraci 2,5 mol/l?) je: Ne. V případě, že farmář bude ředit koncentrovanější roztok vodou, potřebuje ještě o 22 litrů tohoto roztoku více. Při mísení roztoků bez užití vody mu k přípravě 100 litrů směsi bude scházet přibližně 3,3 litru koncentrovanějšího roztoku.
Pozornému čtenáři a uživateli online kalkulátoru jistě neuniklo, že systému při výpočtu nezáleží na tom, s jakou koncentrací pracuje, výsledek je vždy stejný. Je to proto, že výpočet vychází z přímé úměrnosti mezi koncentrací a vyjádřením množství látky. I tak považujeme za vhodné vyžadovat u žáků nastavení typu koncentrace, se kterou počítají. Učí se tím jejich terminologii a vizuálně vnímají jednotky odpovídající konkrétní koncentraci.
Laboratorní průvodce. On-line výpočet koncentrací
Rejstřík pojmů NZIP. https://www.nzip.cz/rejstrikovy-pojem/960
Ardeapharma – Roztoky pro parenterální výživu. https://www.ardeapharma.cz/produkty/roztoky-pro-parenteralni-vyzivu/
Neware. https://www.neware.net/news/what-is-battery-acid/230/53.html
Vyhláška č. 248/2018 Sb. Vyhláška o požadavcích na nápoje, kvasný ocet a droždí. https://www.zakonyprolidi.cz/cs/2018-248
Článek je publikován pod licencí Creative Commons - Uveďte původ-Neužívejte komerčně-Nezpracovávejte 3.0 ČR .
Pro vložení komentáře je nutné se nejprve přihlásit.
Článek není zařazen do žádného seriálu.
Materiály s klíčovým slovem NPO 3.1 DIGI vytvořil tým metodiků v projektu Podpora škol v kontextu digitalizace (Národní plán obnovy 3.1 DIGI) pro podporu pedagogů při ICT revizích.
Další informace, metodické materiály i inspiraci do výuky jednotlivých předmětů i napříč předměty najdete na webu https://digitalizace.rvp.cz/

Národní pedagogický institut České republiky © 2025