Žák/žákyně
K efektivnímu využívání internetových nástrojů ke zjištění molárních hmotnostních látek a grafickému znázornění poměrových zastoupení prvků.
Nástroj ChemicalAid rychle a efektivně poskytne hodnotu molekulové hmotnosti látky, současně zobrazí informace o hmotnostním zlomku jednotlivých prvků v molekule a grafickou podobu těchto údajů, díky níž uživatelé posílí povědomí o souvislosti hmotnosti prvku s jeho hmotnostním zastoupením (vyjádřeným v procentech) ve sloučenině.
ChemicalAid je originálně v anglickém jazyce, jednoduše lze nastavit (v pravé části horní lišty) češtinu (obr. 1, pro zvětšení klikněte na obrázek), musíme ale počítat s jistým omezením.
Některé části stránek zůstávají v angličtině, ale pro naše využití nás to nijak neomezí. Stránky nabízí několik interaktivních pomůcek a také informací, v aktivitě využijeme jednu z kalkulaček (obr. 2).
V levé dolní části jsou stručně uvedeny instrukce, se kterými je třeba žáky seznámit. Ke stejným informacím se dostaneme, pokud klikneme na Pokyny . Vstupní řádek je nejdelší, zde zapisujeme podle pokynů vzorec látky. K tomu lze také využít značky prvků z nabídky tabulky, která se zobrazí po kliknutí na obrázek překřížených ručních mechanických nástrojů.
Vyučující si pro úkol č. 2 předem připraví seznam názvů chemických látek, které chce žákům zadat. Na nich je pak správné vytvoření vzorce a užití zmíněné kalkulačky. Látky zadáváme v podobě racionálních nebo sumárních vzorců, kalkulačka vypočítá molekulovou hmotnost z obou typů.
Aktivitu lze použít opakovaně, např. po probrání názvosloví dvouprvkových sloučenin, poté kyselin a hydroxidů, solí, hydrogensolí, solí-hydrátů, organických sloučenin, … Na střední škole ji můžeme zařadit také do tématu o hmotnostech atomů a molekul a zaměřit se více na analytickou část aktivity.
První úlohu řešíme se žáky frontálně, následuje společná diskuze. Úlohu 2 pak zpracovávají žáci samostatně.
S žáky se předem domluvíme na potřebné přesnosti číselných hodnot. V řešení uvádíme zobrazené hodnoty.
Molární hmotnost vody je\[ \small18{,}015\,3\ \mathrm{g/mol} \], relativní molekulová hmotnost vody je\[ \small18{,}015\,3 \] (obr. 3).
Molární hmotnost 2 atomů vodíku je\[ \small2{,}015\,9\ \mathrm{g/mol} \], jednoho atomu kyslíku\[ \small15{,}999\,4\ \mathrm{g/mol} \]; součet obou těchto hmotností se rovná molární hmotnosti vody.
Dva atomy vodíku v molekule vody tvoří\[ \small11{,}189\,8\ \% \] celkové hmotnosti molekuly vody, jeden atom kyslíku tvoří\[ \small88{,}810\,2\ \% \] celkové hmotnosti vody.
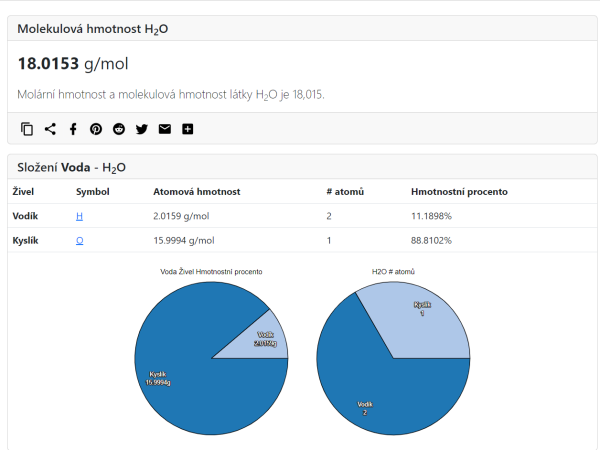
První diagram graficky znázorňuje hmotnostní zastoupení prvků v molekule vody. Druhý diagram znázorňuje zastoupení prvků počtem atomů. Poměr počtu atomů vodíku a kyslíku je\[ \small2:1 \], což na první pohled neodpovídá poměru hmotností těchto prvků. Je vidět, že vodík je mnohonásobně lehčí než kyslík.
Určete vzorec a zjistěte pomocí online kalkulačky ChemicalAid molární hmotnost vybraných látek (zadá vyučující), zapište vše do sešitu.
V úloze 1 si část žáků nevšimla nepřesné slovní formulace o molární hmotnosti vody (neuvedeny jednotky).
Kontrola výsledků proběhla společným zápisem na tabuli. Žáci spíše chybují v samotném sestavení vzorce než při zadávání do příkazového řádku.
Rychlejší žáky vyzveme, aby namátkou zkontrolovali zobrazené hodnoty molárních hmotností látek výpočtem.
V závěru hodiny je vhodné shrnout rozdíl mezi molární a relativní molekulovou hmotností látky.
Článek je publikován pod licencí Creative Commons - Uveďte původ-Neužívejte komerčně-Nezpracovávejte 3.0 ČR .
Článek nebyl prozatím komentován.
Pro vložení komentáře je nutné se nejprve přihlásit.
Článek není zařazen do žádného seriálu.
Materiály s klíčovým slovem NPO 3.1 DIGI vytvořil tým metodiků v projektu Podpora škol v kontextu digitalizace (Národní plán obnovy 3.1 DIGI) pro podporu pedagogů při ICT revizích.
Další informace, metodické materiály i inspiraci do výuky jednotlivých předmětů i napříč předměty najdete na webu https://digitalizace.rvp.cz/

Národní pedagogický institut České republiky © 2025